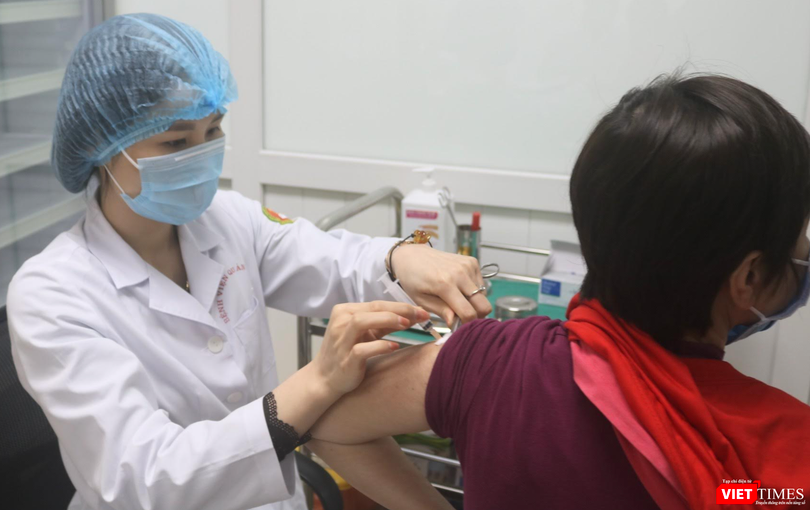
Theo nguồn tin của VietTimes, hôm qua, ngày 22/8, Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia (Bộ Y tế) đã họp để thẩm định kết quả thử nghiệm giai đoạn 3a vaccine phòng COVID-19 Nanocovax. Tuy nhiên, đến thời điểm hiện tại Hội đồng vẫn chưa có kết luận.
Chưa công bố kết luận
Trước "tin đồn" Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia đã thông qua việc việc cấp phép cho vaccine thử nghiệm Nanocovax vào ngày 22/8, sáng nay, 23/8, PV VietTimes đã liên hệ với PGS. TS. Lê Văn Truyền – Chủ tịch Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) để hỏi về vấn đề này.
Trao đổi với Pv VietTimes, PGS. TS. Lê Văn Truyền cho biết: “Trong ngày 22/8, Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia đã họp để thẩm định kết quả thử nghiệm giai đoạn 3a vaccine phòng COVID-19 Nanocovax của Nanogen. Về kết quả thử nghiệm giai đoạn 3a vaccine phòng COVID-19 Nanocovax thì Hội đồng Đạo đức có trách nhiệm trả lời vấn đề này. Còn Hội đồng đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc chỉ họp để xem xét cấp phép vaccine sau khi Hội đồng Đạo đức có biên bản nghiệm thu các kết quả thử nghiệm và nghiên cứu vaccine Nanocovax. Công ty Nanogen cần nộp toàn bộ hồ sơ đăng ký lưu hành vaccine Nanocovax cho Cục Quản lý Dược”.
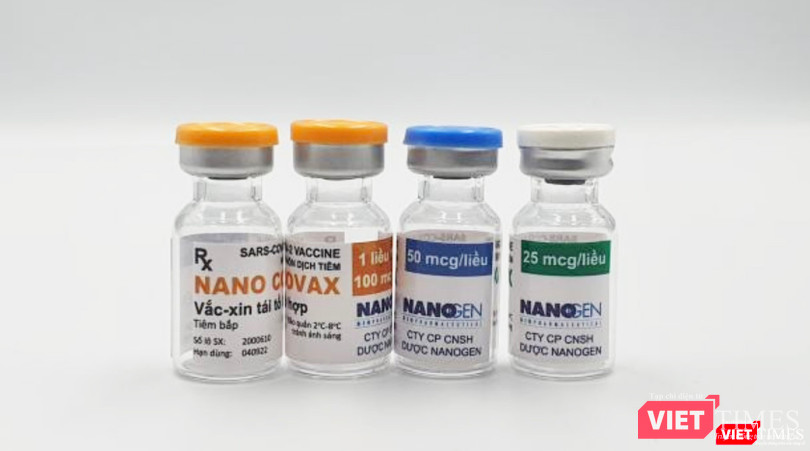 |
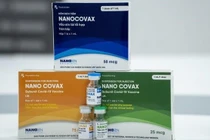
| Vaccine phòng COVID-19 Nanocovax (Ảnh - MT) |
Đại diện nhóm nghiên cứu (không muốn tiết lộ tên) cho biết: "Bộ Y tế sẽ thông báo kết luận thẩm định của Hội đồng Đạo đức trong thời gian sớm nhất".
Theo Bộ Y tế, hồ sơ kết quả nghiên cứu lâm sàng giai đoạn 1, 2, kết quả giữa kỳ giai đoạn 3a là căn cứ để xem xét có chấp thuận đề xuất cấp phép khẩn cấp đối với Nanocovax hay không. Các dữ liệu này phải chứng minh được vaccine an toàn, hiệu quả, hồ sơ chặt chẽ, khoa học.
Cấp giấy đăng ký cho vaccine COVID-19 trong 20 ngày
Mới đây, Bộ Y tế đã ban hành Thông tư hướng dẫn đăng lý lưu hành vaccine phòng COVID-19 trong trường hợp cấp bách. Thông tư đã quy định chi tiết việc đăng ký lưu hành vaccine phòng COVID-19, hồ sơ, thủ tục cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành vaccine phòng COVID-19; yêu cầu về dữ liệu lâm sàng trong hồ sơ đăng ký để bảo đảm an toàn, hiệu quả vaccine và trường hợp được miễn 1 hoặc một số giai đoạn thử vaccine lâm sàng, vaccine phải thử lâm sàng giai đoạn 4 tại Việt Nam.
Theo Bộ Y tế, vaccine phòng COVID-19 đủ điều kiện sẽ được cấp giấy đăng ký lưu hành trong vòng 20 ngày làm việc kể từ khi nhận đủ hồ sơ. Cục trưởng Cục Quản lý Dược sẽ cấp giấy đăng ký lưu hành vaccine. Trường hợp không cấp hoặc chưa cấp, Cục Quản lý Dược phải có văn bản thông báo và nêu rõ lý do.
Bộ Y tế cho hay: Dữ liệu lâm sàng trong hồ sơ đăng ký lưu hành vaccine phải thực hiện theo quy định của Bộ Y tế. Đối với vaccine đăng ký được sản xuất tại địa điểm sản xuất hoặc cơ sở sản xuất khác với vaccine dùng trong thử nghiệm lâm sàng, cơ sở được sử dụng dữ liệu lâm sàng của vaccine dùng trong thử nghiệm lâm sàng phải chứng minh việc thay đổi địa điểm sản xuất hoặc cơ sở sản xuất không ảnh hưởng tới tiêu chuẩn chất lượng của vaccine. Trường hợp cơ sở đăng ký hoặc cơ sở sản xuất không phải là chủ sở hữu hoặc không thuộc cùng tập đoàn với chủ sở hữu dữ liệu lâm sàng thì phải được chủ sở hữu cho phép sử dụng dữ liệu lâm sàng.
Sau khi được cấp giấy đăng ký lưu hành, cơ sở đăng ký phối hợp với cơ sở sản xuất tiếp tục đánh giá tính an toàn, tính sinh miễn dịch trên quần thể đích tại Việt Nam trong quá trình sử dụng theo hướng dẫn của Bộ Y tế (Cục Khoa học công nghệ và Đào tạo) đối với các vaccine chưa được cấp phép lưu hành bởi cơ quan quản lý dược chặt chẽ (Stringent Regulatory Authorities – SRA).
 |
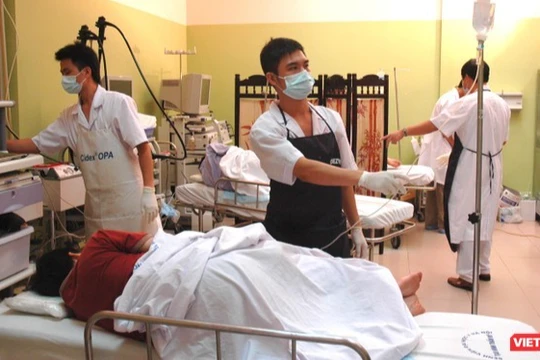
| Nhân viên y tế tiêm vaccine cho tình nguyện viên (Ảnh - Minh Thuý) |
Đáng chú ý, Bộ Y tế cho biết: Vaccine phòng COVID-19 sản xuất trong nước đang thực hiện thử nghiệm lâm sàng, nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch của vaccine sẽ được xem xét cấp giấy đăng ký lưu hành có điều kiện, trên cơ sở ý kiến tư vấn của Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia đối với vaccine thực hiện thử lâm sàng tại Việt Nam và ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với từng vaccine cụ thể, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế thế giới (WHO).
Vaccine được cấp trong trường hợp trên phải được tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về đối tượng, số lượng, phạm vi sử dụng sau khi cấp giấy đăng ký lưu hành. Sau khi được cấp phép lưu hành, cơ sở đăng ký phối hợp với cơ sở sản xuất tiếp tục thực hiện nghiên cứu lâm sàng và cập nhật dữ liệu lâm sàng theo hướng dẫn của Bộ Y tế (Cục Khoa học công nghệ và Đào tạo).
Bên cạnh đó, Bộ Y tế yêu cầu vaccine đã được cấp giấy đăng ký lưu hành tại Việt Nam khi có các thay đổi, bổ sung liên quan đến dữ liệu lâm sàng so với hồ sơ đăng ký vaccine đã được phê duyệt, cơ sở đăng ký phải bổ sung dữ liệu lâm sàng theo quy định tại phụ lục II ban hành kèm theo Thông tư số 32/2018/TT-BYT hoặc phù hợp với hồ sơ kỹ thuật chung ICH-CTD (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) - Common Technical Document (CTD)) hoặc một trong các hướng dẫn của Cơ quan Quản lý Dược và Thực phẩm Mỹ (United States Food and Drug Administration – USFDA), Cơ quan quản lý Dược phẩm Châu Âu (European Medicines Agency – EMA), Cơ quan quản lý thuốc và các sản phẩm y tế của Vương quốc Anh (Medicines and Healthcare products Regulatory Agency – MHRA) hoặc Tổ chức Y tế thế giới (WHO).
Hiện, Nanocovax là vaccine phòng COVID-19 đầu tiên của Việt Nam đã tiến hành thử nghiệm lâm sàng giai đoạn 3.
Trước khi thử nghiệm giai đoạn vaccine Nanocovax đã trải qua 2 giai đoạn thử nghiệm lâm sàng: Giai đoạn 1 bắt đầu từ ngày 18/12, giai đoạn 2 từ ngày 26/2 và giai đoạn 3 từ ngày 11/6.
Theo đề cương đã được phê duyệt, giai đoạn 3 tiêm thử nghiệm vaccine Nanocovax nhằm đánh giá yếu tố hiệu lực bảo vệ của vaccine đối với cộng đồng và được thực hiện tại nhiều trung tâm trong nước với 13.000 người; chỉ thực hiện tiêm nhóm liều duy nhất 25 mcg và nhóm tiêm giả dược đối chứng. Giai đoạn 3 chia làm 2 pha là pha 3a và pha 3b.