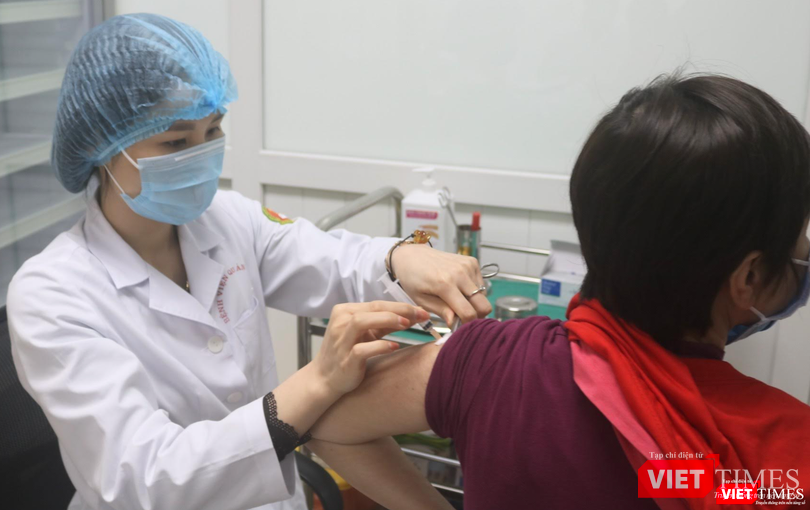
Sau khi Hội đồng Đạo đức trong nghiên cứu Y Sinh học Quốc gia (Bộ Y tế) họp để thẩm định kết quả thử nghiệm giai đoạn 3a vaccine phòng COVID-19 Nanocovax của Nanogen vào ngày 22/8 nhưng chưa thông báo kết luận, trên mạng xã hội Facebook đã xuất hiện rất nhiều thông tin cho rằng Hội đồng đã thông qua kết quả thử nghiệm vaccine Nanocovax giai đoạn 3a và đề nghị cấp phép khẩn cấp.
Thông tin về vaccine phòng COVID-19 Nanocovax được lan truyền trên mạng xã hội đã khiến không ít người dân tin tưởng Hội Đồng Đạo Đức trong nghiên cứu Y Sinh học Quốc gia đã đưa ra kết luận chính thức, nên việc cấp phép vaccine này là đương nhiên. Tuy nhiên, thực tế thì việc cấp phép vaccine vẫn còn ở phía trước, vì khi thông tin với VietTimes, PGS. TS. Lê Văn Truyền – Chủ tịch Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) - cho biết, để được cấp phép, Hội đồng Đạo đức phải có biên bản nghiệm thu các kết quả thử nghiệm và nghiên cứu vaccine Nanocovax, đồng thời, Công ty Nanogen cần nộp toàn bộ hồ sơ đăng ký lưu hành vaccine Nanocovax cho Cục Quản lý Dược.
Để làm rõ hơn quá trình cấp phép khẩn cấp vaccine phòng COVID-19 Nanocovax của Nanogen - yếu tố quan trọng nhất để vaccine này được cấp phép khẩn cấp - PV VietTimes đã có cuộc trao đổi với TS. Nguyễn Hữu Huân - Giám đốc Khoa học Công ty IGY Life Sciences, giáo sư kiêm nhiệm Đại học Arizona, là chuyên gia đang sống tại Mỹ với 27 năm nghiên cứu vaccine và miễn dịch chống virus, từng nghiên cứu khoa học về vaccine chống cúm và SARS.
+ Xin ông cho biết khi thử nghiệm lâm sàng vaccine phòng COVID-19 Nanocovax, 3 yếu tố gồm: tính an toàn, tính sinh miễn dịch và hiệu quả bảo vệ cần đạt chỉ số ra sao?
TS. Nguyễn Hữu Huân: Tôi không có số liệu. Tuy nhiên vaccine phòng COVID-19 Nanocovax đã được thông qua giai đoạn 1 và 2 để thử giai đoạn 3 tức là kết quả an toàn và sinh miễn dịch tốt. Trong giai đoạn 3, vaccine sẽ tiếp tục đánh giá an toàn và sinh miễn dịch ở số người được tiêm lớn hơn và đánh giá hiệu quả bảo vệ.
Để có được kết quả bảo vệ có ý nghĩa về thống kê, giai đoạn 3 phụ thuộc rất nhiều vào số lượng những người bị nhiễm SARS-CoV-2 trong cộng đồng. Tuy số ca bị nhiễm SARS-CoV-2 ở Việt Nam tăng so với trước đây nhưng chưa phải cao để sớm có đủ số liệu cho giai đoạn 3.
 |
| TS. Nguyễn Hữu Huân - Giám đốc Khoa học Công ty IGY Life Sciences, giáo sư kiêm nhiệm Đại học Arizona, là chuyên gia đang sống tại Mỹ với 27 năm nghiên cứu vaccine và miễn dịch chống virus, từng nghiên cứu khoa học về vaccine chống cúm và SARS (Ảnh - NVCC) |
+ Quá trình cấp phép khẩn cấp vaccine phòng COVID-19 phải trải qua những giai đoạn nào, thưa ông?
TS. Nguyễn Hữu Huân: Quá trình cấp phép khẩn cấp vaccine phòng COVID-19 ở Mỹ đều phải qua các giai đoạn như xét duyệt bình thường. Việc xem xét sử dụng khẩn cấp vaccine chỉ khác ở điểm linh động duy nhất trong giai đoạn 3 là họ không chờ có được dữ liệu đầy đủ như quy trình thông thường, mà xin ý kiến của một hội đồng chuyên gia độc lập để đánh giá và bỏ phiếu, dựa trên số liệu có được tại thời điểm xét duyệt “khẩn cấp”. Khi xét duyệt sử dụng khẩn cấp có lựa chọn vừa sử dụng vừa đánh giá.
+ Sau khi vaccine phòng COVID-19 Nanocovax kết thúc quá trình tiêm thử nghiệm lâm sàng giai đoạn 3a, ông đánh giá thế nào về việc cấp phép sớm cho vaccine phòng COVID-19 Nanocovax?
TS. Nguyễn Hữu Huân: Tôi không có số liệu. Theo tôi, kể cả có số liệu giai đoạn 3a thì cũng không đủ số liệu để đạt kết quả có ý nghĩa về mặt thống kê. Trong tình trạng khẩn cấp như hiện nay, việc vừa cho phép sử dụng khẩn cấp vừa tiếp tục thử nghiệm là lựa chọn tốt.
+ Ông kỳ vọng như thế nào về vaccine phòng COVID-19 đầu tiên của Việt Nam? Theo ông, sẽ mất bao lâu thì vaccine phòng COVID-19 Nanocovax có thể được cấp phép?
TS. Nguyễn Hữu Huân: Về cơ sở khoa học và dựa trên những thử nghiệm lâm sàng các vaccine phòng COVID-19 đang được lưu hành, thì tôi cho rằng vaccine phòng COVID-19 Nanocovax an toàn và hiệu quả. Về việc bao lâu vaccine phòng COVID-19 Nanocovax được cấp phép sử dụng khẩn cấp thì còn phụ thuộc vào nhiều yếu tố.
Tuy nhiên, theo quan điểm của tôi (cách đánh giá của FDA Mỹ) thì, yếu tố quan trọng nhất để vaccine phòng COVID-19 Nanocovax được cấp phép sử dụng khẩn cấp là đánh giá của Hội đồng các chuyên gia có bề dầy trong lĩnh vực vaccine và các chế phẩm sinh học liên quan đến vaccine. Hội đồng sẽ đánh giá ý nghĩa của số liệu có được và cân nhắc giữa rủi ro và lợi ích.
 |
| Vaccine phòng COVID-19 Nanocovax (Ảnh - VT) |
+ Hiện nay đang có một số ý kiến cho rằng việc Công ty Nanogen ký kết hợp tác với HLB Ceutical của Hàn Quốc và Tập đoàn dược phẩm Vekaria (Ấn Độ) thực chất đều là "chiêu trò"của Nanogen vì HLB Ceutical của Hàn Quốc mua cổ phần của Nanogen bằng hình thức chuyển giao công nghệ, trong Ban giám đốc của Nanogen có thành phần của HLB. Về phần Tập đoàn dược phẩm Vekaria (Ấn Độ), Nanogen bắt tay với họ là để nhờ tập đoàn này sản xuất vaccine, mang về Việt Nam bán. Quan điểm của ông về ý kiến này như thế nào ạ?
TS. Nguyễn Hữu Huân: Hiện, tôi không có đủ thông tin tin cậy để đánh giá việc này.
+ Cảm ơn ông về cuộc trò chuyện!