|
Ngay khi Việt Nam cơ bản kiểm soát được dịch bệnh, việc thiếu thuốc điều trị trở thành vấn đề xã hội. Quốc hội và Chính phủ đều có những chỉ đạo sát sao để nhanh chóng khắc phục tình trạng này. Khi Ủy ban Thường vụ Quốc hội ban hành Nghị quyết số 12/2021/UBTVQH15 ngày 30/12/2021 cho phép thực hiện một số chính sách đặc biệt phục vụ công tác phòng, chống dịch Covid-19, Bộ Y tế đã chủ động phối hợp với các bộ, ngành, địa phương thực hiện Nghị quyết với việc gia hạn lưu hành thuốc, đồng thời, chủ động có các biện pháp khắc phục tình trạng này. Bước sang năm 2023, Bộ Y tế tiếp tục có những giải pháp nhằm tạo thuận lợi cho việc cung ứng thuốc, đảm bảo đủ thuốc ở các bệnh viện.
Với mong muốn mang đến bạn đọc thông tin mới nhất về những nỗ lực của Bộ Y tế trong việc giải “cơn khát” thuốc trong các bệnh viện, VietTimes đã có cuộc trao đổi với Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên:
 |
| Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên |
Thưa Thứ trưởng! Tại kỳ họp bất thường trong tháng 1 vừa qua, Quốc hội đã thông qua việc cho phép tiếp tục sử dụng giấy phép gia hạn thuốc đã hết hạn lưu hành mà Luật Dược hiện chưa đáp ứng được. Thứ trưởng có thể cho biết việc này có ý nghĩa như thế nào với ngành y?
Thứ trưởng Đỗ Xuân Tuyên: Ngày 09/01/2023, Quốc hội đã thông qua Nghị quyết số 80/2023/QH15 cho phép Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc hết thời hạn hiệu lực từ ngày 01/01/2023 đến ngày 31/12/2024 đã được cơ sở đăng ký nộp hồ sơ gia hạn và giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc được kéo dài thời hạn thực hiện theo quy định tại khoản 5 Điều 6 của Nghị quyết số 12/2021/UBTVQH15 mà chưa được gia hạn kịp thời theo quy định của Luật Dược được tiếp tục sử dụng từ ngày hết hiệu lực đến hết ngày 31/12/2024. Cơ chế này chỉ áp dụng đối với các thuốc đã có đầy đủ dữ liệu chứng minh chất lượng, an toàn, hiệu quả trong quá trình lưu hành.
Nghị quyết ra đời có ý nghĩa rất lớn, đáp ứng kịp thời yêu cầu của thực tiễn, thể hiện tinh thần trách nhiệm cao của Quốc hội trước nhân dân; khẳng định Quốc hội luôn hành động, đồng hành cùng Chính phủ và cả hệ thống chính trị. Việc áp dụng cơ chế này giúp đảm bảo ổn định nguồn cung ứng thuốc cho nhu cầu chăm sóc và bảo vệ sức khỏe của nhân dân cũng như hoạt động sản xuất, kinh doanh của doanh nghiệp, đồng thời cho phép cơ quan quản lý có thời gian giải quyết hồ sơ gia hạn tồn đọng trong giai đoạn dịch Covid-19 và sửa đổi, bổ sung Luật dược phù hợp với tình hình thực tiễn hiện nay.
Xin Thứ trưởng cho biết, sau Nghị quyết này, Bộ Y tế sẽ triển khai như thế nào để có ngay thuốc phục vụ người dân, tránh tình trạng chậm triển khai, gây thiếu thuốc tại các cơ sở y tế như thời gian qua?
Thứ trưởng Đỗ Xuân Tuyên: Hiện tại, có trên 21.000 thuốc có giấy đăng ký lưu hành còn hiệu lực năm 2022, về cơ bản đủ thuốc phục vụ công tác phòng chữa bệnh cho nhân dân. Tuy nhiên, ở một số cơ sở y tế, do liên quan đến hoạt động mua sắm đấu thầu, có thể thiếu một số thuốc chuyên khoa, thuốc hiếm do khó khăn về nguồn cung ứng (các thuốc này hầu như năm nào cũng có 1 số thuốc thiếu do không xác định được nhu cầu vì các bệnh hiếm gặp và không lường trước về thời điểm, số lượng).
Thưa Thứ trưởng! Dự kiến sẽ có bao nhiêu thuốc sẽ được gia hạn trong thời gian này và khả năng xử lý hồ sơ của Bộ Y tế như thế nào ạ?
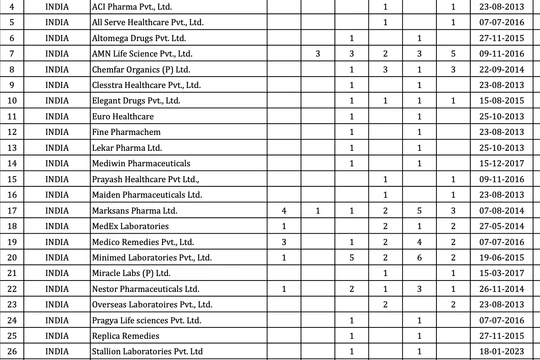
Thứ trưởng Đỗ Xuân Tuyên: Từ thực tiễn và kinh nghiệm đúc kết khi triển khai Nghị quyết số 30/2021/QH15 của Quốc hội và Nghị quyết số 12/2021/UBTVQH15 của Ủy Ban thường Vụ Quốc hội; Nghị quyết số 80/2023/QH15 đã giúp đảm bảo đầy đủ cơ sở pháp lý vững chắc để triển khai, Bộ Y tế đã rà soát các thuốc đủ điều kiện theo tiêu chí của Nghị quyết, công bố gần 9.000 thuốc.
Ngoài ra, Bộ Y tế đã và sẽ tiếp tục công bố theo nhiều đợt phù hợp với lộ trình nộp hồ sơ gia hạn của doanh nghiệp và trước thời điểm hết hiệu lực giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
Song song với việc công bố thuốc, nguyên liệu làm thuốc được tiếp tục sử dụng giấy đăng ký lưu hành theo Nghị quyết số 80/2023/QH15 nêu trên, Bộ Y tế vẫn tiếp tục khẩn trương giải quyết gia hạn giấy đăng ký lưu hành theo quy định tại Luật Dược 2016.
 |
Với nhiều giải pháp đã triển khai, dự kiến Bộ Y tế sẽ có thể giải quyết được khoảng 6.000 hồ sơ gia hạn/năm, do đó đến hết năm 2024 sẽ giải quyết được cơ bản hết số hồ sơ gia hạn tồn đọng và hồ sơ gia hạn nộp mới trong thời gian tới.
Khi triển khai nội dung này, Bộ Y tế có gặp phải khó khăn gì và hướng giải quyết những khó khăn ra sao thưa Thứ trưởng?
Thứ trưởng Đỗ Xuân Tuyên: Việc triển khai công bố danh mục theo Nghị quyết 80/2023/QH15 là hoàn toàn khả thi. Bộ Y tế sẽ thực hiện công bố theo nhiều đợt phù hợp với lộ trình nộp hồ sơ gia hạn của doanh nghiệp và thời điểm hết hiệu lực giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
Đối với những khó khăn trong giải quyết hồ sơ gia hạn, Bộ Y tế đã triển khai đồng bộ nhiều giải pháp để nâng cao khả năng giải quyết, xử lý hồ sơ gia hạn. Trong đó đã đẩy mạnh việc cắt giảm, đơn giản hóa thủ tục hành chính; tổ chức thêm các đơn vị thẩm định độc lập tại các trường đại học y, dược; ổn định tư tưởng cho cán bộ, công chức và chuyên gia thẩm định hồ sơ; sửa đổi quy định về thu phí đăng ký thuốc và chế độ thù lao cho chuyên gia để thúc đẩy công tác thẩm định hồ sơ,…
Về lâu dài, Bộ Y tế sẽ sửa đổi, bổ sung Luật Dược trong đó dự thảo đang đề xuất sửa đổi theo hướng nghiên cứu áp dụng kinh nghiệm của các nước, đơn giản hóa tối đa yêu cầu về hồ sơ, thủ tục và quy trình gia hạn giấy đăng ký lưu hành.
Được biết Bộ Y tế đã đệ trình lên Chính phủ sửa đổi Luật Dược đang có nhiều bất cập hiện nay, trong đó có vấn đề gia hạn giấy phép lưu hành thuốc. Xin Thứ trưởng cho biết cụ thể hơn về những bổ sung này, cũng như những bất cập của Luật Dược hiện hành cần phải được sửa đổi?
 |
Thứ trưởng Đỗ Xuân Tuyên: Theo quy định của Luật Dược hiện hành, hồ sơ đề nghị gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc phải nộp nhiều loại giấy tờ, hồ sơ, tài liệu hành chính, phải được thẩm định và trình Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, mặc dù tại thời điểm gia hạn nhiều thuốc không thay đổi nội dung về kỹ thuật, chỉ thay đổi về mặt hành chính.
Do đó, thời gian giải quyết hồ sơ đề nghị gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc bị kéo dài, dẫn tới tình trạng gián đoạn sản xuất, lưu hành và cung ứng thuốc do thuốc hết hạn giấy đăng ký lưu hành mà chưa được gia hạn giấy đăng ký lưu hành.
Để đảm bảo nguồn cung ứng thuốc cho người dân, tại dự thảo Luật Dược, Bộ Y tế trình Chính phủ đề xuất sửa đổi theo hướng tạo điều kiện cho doanh nghiệp: doanh nghiệp nộp đơn đề nghị gia hạn và cung cấp các thông tin cập nhật về tình hình lưu hành thuốc, nguyên liệu làm thuốc tại nước sở tại, tình trạng cơ sở sản xuất và cơ sở đăng ký thuốc, nguyên liệu làm thuốc làm cơ sở để Bộ Y tế thực hiện hậu kiểm.
Luật Dược số 105/2016/QH13 được Quốc hội thông qua ngày 6/4/2016 và có hiệu lực thi hành từ ngày 1/7/2017 đã tạo được hành lang pháp lý đầy đủ cho công tác quản lý Nhà nước về Dược và đã tạo điều kiện cho ngành Dược phát triển, đảm bảo đáp ứng đủ nhu cầu sử dụng thuốc của người bệnh góp phần hiệu quả trong công tác chăm sóc cho người dân.
 |
Qua tổng kết 5 năm triển khai thi hành, Luật Dược 2016 đã cho thấy một số quy định đã không còn phù hợp với yêu cầu thực tiễn hiện nay và đã trở thành rào cản, khó khăn cho hoạt động sản xuất, kinh doanh dược, ảnh hưởng đến việc bảo đảm cung ứng thuốc cho nhân dân, đặc biệt trong các trường hợp cấp bách phòng, chống dịch bệnh vừa qua và Luật Dược còn thiếu những quy định điều chỉnh một số hoạt động sản xuất, kinh doanh mới phát sinh trong tiến trình hội nhập quốc tế và khu vực của Việt Nam. Vì thế, Bộ Y tế đã dự thảo đề xuất sửa đổi liên quan đến các nội dung sau:
1. Về hồ sơ, thủ tục gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
2. Việc công bố, chấp nhận các bộ nguyên tắc, tiêu chuẩn Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc của các nước
3. Đối với quy định thử thuốc trên lâm sàng để phục vụ đăng ký lưu hành
4. Về kiểm nghiệm thuốc, nguyên liệu làm thuốc, bao bì tiếp xúc trực tiếp với thuốc đáp ứng với nhu cầu phòng, chống dịch bệnh
5. Về việc chuyển đổi mục đích sử dụng dược chất đã được cấp phép nhập khẩu cho mục đích khác để sản xuất thuốc phòng, chống dịch bệnh
6. Về quản lý giá thuốc
7. Quy định về cấp phép xuất khẩu, nhập khẩu đối với vắc xin theo quy định của Tổ chức Y tế thế giới (WHO) trong việc đánh giá chứng nhận đạt Cơ quan quản lý nhà nước về vắc xin (NRA)
8. Quản lý thuốc độc và thuốc có chứa hoạt chất thuộc danh mục chất bị cấm sử dụng trong một số ngành, lĩnh vực
9. Về phát triển công nghiệp dược
10. Về phân phối thuốc, nguyên liệu làm thuốc
Xin được cám ơn Thứ trưởng đã trao đổi!
Thực hiện: Thanh Hằng
Trình bày: Văn Lâm