Hội đồng Đạo đức “giục” Nanogen nhanh chóng có kết quả thử nghiệm lâm sàng giai đoạn 2
Tính đến thời điểm hiện tại, Bộ Y tế chưa cập nhật thông tin về kết quả thử nghiệm lâm sàng giai đoạn 2 của vaccine phòng COVID-19 Nano Covax do Nanogen sản xuất.
Trong cuộc họp của Bộ Y tế, Bộ Khoa học & Công nghệ về việc rà soát các hồ sơ, dữ liệu, kết quả nghiên cứu thử nghiệm lâm sàng và xem xét đề xuất cấp phép khẩn cấp vaccine phòng COVID-19 Nano Covax của Công ty Nanogen diễn ra vào hôm qua, ngày 22/7, GS.TS. Phạm Ngọc Đính – thành viên Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia – cho biết: Trong nghiên cứu vaccine cần quan tâm 3 yếu tố: Cập nhật thiết kế, cấp phép có điều kiện và hậu cấp phép. Nếu không giải quyết tốt việc cấp phép có điều kiện thì hậu cấp phép sẽ có những vấn đề phát sinh. Cấp phép có điều kiện cần dựa trên kết quả số liệu có tính liên hoàn, liên tục của giai đoạn 1, 2, 3 nhằm đánh giá tính an toàn, tính sinh miễn dịch.
“Cần hết sức tôn trọng kết quả của thử nghiệm kháng thể trung hòa, nhanh chóng có kết quả thử nghiệm lâm sàng giai đoạn 2, đồng thời, cần tính toán phương án gửi mẫu sang các phòng thí nghiệm nước ngoài để kiểm định, đánh giá đảm bảo tính chuẩn mực khách quan” – GS.TS. Phạm Ngọc Đính nói.
 |
| Buổi làm việc của Bộ Y tế với Bộ Khoa học & Công nghệ về việc rà soát các hồ sơ, dữ liệu, kết quả nghiên cứu thử nghiệm lâm sàng và xem xét đề xuất cấp phép khẩn cấp vaccine phòng COVID-19 Nano Covax (Ảnh - BYT) |
Từ ý kiến của GS.TS. Phạm Ngọc Đính, có thể thấy Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia đang thúc giục Nanogen nhanh chóng có kết quả thử nghiệm lâm sàng giai đoạn 2 vaccine phòng COVID-19 Nano Covax.
Để tìm hiểu rõ hơn về vấn đề này, sáng nay, ngày 23/7, PV VietTimes đã liên hệ với GS. Phùng Đắc Cam – chuyên gia đầu ngành vi sinh lâm sàng Việt Nam và là thành viên của Hội đồng Đạo đức trong nghiên cứu Y sinh học của Bộ Y tế.
Khi được hỏi về việc Nanogen đã công bố kết quả thử nghiệm lâm sàng giai đoạn 2 hay chưa, GS. Phùng Đắc Cam cho biết: “Đến thời điểm hiện tại, các thông tin từ cuộc họp giữa Bộ Y tế và Bộ Khoa học & Công nghệ về việc rà soát các hồ sơ, dữ liệu, kết quả nghiên cứu thử nghiệm lâm sàng và xem xét đề xuất cấp phép khẩn cấp vaccine phòng COVID-19 Nano Covax vẫn chưa rõ ràng nên tôi chưa thể thông tin được. Khi nào có thông tin mới, chúng tôi sẽ thông báo”.
Nangogen đã công bố chính thức kết quả thử nghiệm lâm sàng giai đoạn 2 từ 2 tháng trước
Sau khi ghi nhận những thông tin được cung cấp từ Bộ Y tế, PV VietTimes tiếp tục liên lạc với ông Hồ Nhân – Tổng Giám đốc Nanogen – để tìm hiểu thông tin về kết quả thử nghiệm lâm sàng vaccine phòng COVID-19 Nano Covax giai đoạn 2.
Trái ngược với thông tin mà Bộ Y tế đưa ra, chia sẻ với PV VietTimes, ông Hồ Nhân cho biết: “Kết quả thử nghiệm lâm sàng giai đoạn 1 và 2 vaccine phòng COVID-19 Nano Covax đã được đăng online trên website của Công ty bằng tiếng Việt và tiếng Anh. Trước đó, Nanogen đã gửi báo cáo kết quả thử nghiệm lâm sàng giai đoạn 2 vaccine phòng COVID-19 Nano Covax lên Bộ Y tế từ 2 tháng trước. Bởi phải có kết quả thử nghiệm lâm sàng giai đoạn 2 thì Bộ Y tế mới cho phép tiếp tục thử nghiệm giai đoạn 3”.
 |
| Ông Hồ Nhân – Tổng Giám đốc Nanogen (bên phải) - chia sẻ về việc sản xuất, nghiên cứu vaccine phòng COVID-19 Nano Covax với Thủ tướng Chính phủ Phạm Minh Chính (Ảnh - VGP) |
Như vậy, Nanogen khẳng định đã báo cáo kết quả thử nghiệm lâm sàng lên Bộ Y tế từ tháng 2. Trong báo cáo kết quả thử nghiệm lâm sàng giai đoạn 1 và 2 vaccine phòng COVID-19 Nano Covax, Nanogen đã công bố chi tiết thời gian cũng như từng bước nghiên cứu, thử nghiệm vaccine của Công ty.
Cụ thể: Nghiên cứu giai đoạn 1 bắt đầu vào ngày 10/12/2020 tại Học viện quân Y, đối tượng nghiên cứu giai đoạn 1 gồm người tình nguyện khoẻ mạnh từ 18 đến 50 tuổi, đối tượng được phân bổ theo thiết kế liều tăng dần để đánh giá an toàn, khả năng dung nạp và bước đầu đánh giá tính sinh miễn dịch của vaccine Nano Covax. Tiêu chí đánh giá chính là an toàn sau tiêm. Các lần thăm khám để đánh giá an toàn, khả năng dung nạp và bước đầu đánh giá sinh miễn dịch vào các ngày 0 (tiêm vaccine mũi 1), ngày 7, ngày 28 (tiêm vaccine mũi 1), ngày 35 và ngày 56.
Nhóm nghiên cứu đã thu thập dữ liệu đánh giá liên tục các biến cố bất lợi đã dự kiến (solited adverse event) bằng cách theo dõi liên tục 3 ngày sau tiêm tại điểm nghiên cứu và thông qua nhật ký tham gia nghiên cứu (diary card) cung cấp cho đối tượng trong 7 ngày sau tiêm.
 |
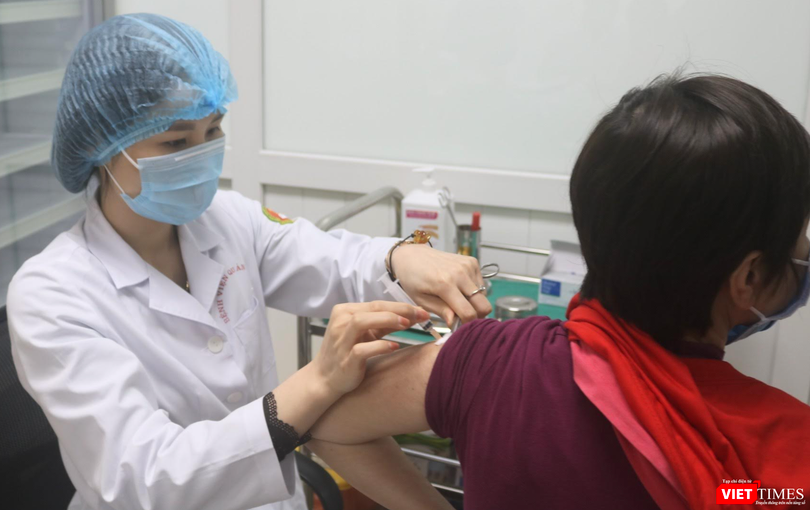
| Tình nguyện viên được khám lâm sàng trước khi tiêm vaccine phòng COVID-19 (Ảnh - Hoàng Anh) |
Dữ liệu đánh giá an toàn của giai đoạn 1 được thu thập bằng các lần thăm khám lâm sàng, đo sinh hiệu tại tất cả các lần thăm khám. Ngoài ra, đối tượng tham gia nghiên cứu còn thực hiện các cận lâm sàng bằng các xét nghiệm công thức máu; sinh hoá về chức năng gan, thận; tổng phân tích nước tiểu) và các chuẩn đoán hình ảnh (siêu âm bụng, tim, X-quang, ECG) tại lần thăm khám sàng lọc, thăm khám ngày 28 (trước khi tiêm mũi 2) và thăm khám ngày 56.
Đánh giá sơ bộ sinh miễn dịch, nhóm nghiên cứu sử dụng enzyme-linked immunosorbent assay (ELISA) để đánh giá hàm lượng kháng thể kháng protein S (Anti-S IgG), hoạt tính trung hoà bằng SARS-CoV-2 Surrogate virus Neutralization Test kit của Genscript.
Từ ngày 10/12/2020 đã có 60 đối tượng (độ tuổi trung bình 25, phạm vi về độ tuổi là từ 20 nhỏ nhất và 49 tuổi lớn nhất. Về giới tính, tỷ lệ nam giới là 41,7%, dân tộc Kinh với 96,7%), được thu tuyển và tiêm Nano covax mũi 1 và trong những đối tượng này tất cả đều được tiêm Nanocovax mũi 2. Các biến cố ngoài dự kiến phổ biến nhất là ho, đau họng, viêm họng, không ghi nhận bất cứ biến cố bất lợi nghiêm trọng nào.
Sau khi đánh giá sơ bộ kết quả giai đoạn 1, nhóm nghiên cứu Học Viện Quân Y đã báo cáo Hội Đồng Đạo Đức trong Nghiên cứu Y Sinh và được chấp thuận tiếp tục nghiên cứu giai đoạn 2. Bộ Y tế đã có quyết định để đánh giá chi tiết về an toàn, sinh miễn dịch từ đó có cơ sở để chọn liều tối ưu để tiến hành thử nghiệm giai đoạn 3.
Giai đoạn 2 thử nghiệm lâm sàng vaccine phòng COVID-19 Nano Covax được thực hiện tại Học Viện Quân Y và Viện Pasteur TP.HCM, điểm nghiên cứu Trung Tâm Y Tế huyện Bến Lức, Long An.
Mục tiêu của nghiên cứu giai đoạn 2 nhằm đánh giá tính an toàn, khả năng dung nạp và so sánh đáp ứng sinh miễn dịch của 3 liều ứng viên vaccine Nano Covax tiêm bắp liều 25 mcg, 50 mcg, 75 mcg trên người Việt Nam tình nguyện trưởng thành. Từ đó xác định liều dùng tối ưu của vaccine nghiên cứu. Thiết kế nghiên cứu gồm: mù đói, ngẫu nhiên, so sánh giá dược nhằm đánh giá an toàn và đáp ứng miễn dịch của 3 liều vaccine Nano Covax 25 mcg, 50 mcg và 75 mcg. Tổng cộng có 560 đối tượng được phân ngẫu nhiên vào 4 nhóm, trong đó 480 đối tượng vào nhóm sử dụng vaccine (160 đối tượng tiêm Nanocovax 25mcg, 160 đối tượng tiêm Nanocovax 50 mcg và 160 đối tượng tiêm Nanocovax 75 mcg) và 80 đối tượng vào nhóm tiêm giả dược (tá chất Aluminum hydroxide) tương ứng tỉ lệ 2 (25mcg): 2 (50mcg): 2 (75mcg): 1 (giả dược). Giai đoạn 2 sẽ được phân tầng thành 2 nhóm tuổi: Từ đủ 18 đến 60 tuổi và trên 60 tuổi.
 |
| Tình nguyện viên tiêm thử nghiệm vaccine ở Học viện Quân Y (Ảnh - Minh Thuý) |
Tất cả các đối tượng tham gia nghiên cứu giai đoạn 2 đều được tiêm bắp. Khoảng cách giữa 2 liều là 28 ngày. Dựa trên kết quả hoạt tính trung hoà, nhóm nghiên cứu phát hiện tỷ lệ đối tượng dương tính với kháng thể trung hoà (hoạt tính trung hoà > 30%) tại ngày 35 của 4 nhóm lần lượt là 80,4%, 82,9%, 86,2 % và 1,3%. Tại ngày 42 (14 ngày sau tiêm mũi 2), tỷ lệ đối tượng dương tính với kháng thể trung hoà của 4 nhóm lần lượt là 100%, 100%, 98,7% và 1,3%. 90 sau tiêm, tỷ lệ đối tượng dương tính với kháng thể trung hoà của 4 nhóm lần lượt là 94,3%, 96,2%, 93,7% và 15%.
Kháng thể trung hoà huyết thanh của 4 nhóm được đánh giá ngẫu nhiên trên chủng Vũ Hán và trên biển chủng Anh (B117). Đối với chủng Vũ Hán, GMT tại ngày 42 gần gấp 3 lần so với ngày 35. Trong khi đó, các mẫu huyết thanh của nhóm giả dược tại ngày 35 và 42 không cho thấy khả năng trung hoà.
Sau khi tiêm thử nghiệm, nhóm nghiên cứu của Nanogen đã phân tích hiệu quả đáp ứng miễn dịch. Kết quả cho thấy nồng độ anti S- IgG của cả 3 liều vaccine Nano Covax tăng dần từ 20 đến D35, D42. Tăng cao nhất ở D42. Nhóm placebo có trung bình nhân (GMC) nồng độ anti S-IgG rất thấp, bằng 4,283% vào D35 và bằng 0,51% vào D42 của liều 25mcg.
Trong nghiên cứu này, nhóm giả dược không có tính sinh miễn dịch. Trong khi đó 3 nhóm tiêm vaccine đều có nồng độ kháng thể IgG kháng Protein S của SARS-COV-2 tăng ở thời điểm D28 và đạt nồng độ IgG cao tại thời điểm D42. Nhóm tiêm liều 25 mcg có nồng độ kháng thể IgG D42 cao nhất. Như vậy, Nano Covax cho thấy đáp ứng miễn dịch thể hiện qua nồng độ anti-S-IgG và hoạt tính trung hoà cao hơn rất nhiều lần nhóm giả dược. Tham khảo dữ liệu đáp ứng miễn dịch vaccine cùng và khác bản chất, có xu hướng tương tự. Hoạt tính IgG trung hòa Sars COV 2 In vitro tỉ lệ thuận với nồng độ kháng thể IgG tăng và có hoạt tính trung hòa mạnh ở thời điểm D42. Cả 3 nhóm đều có hoạt tính IgG trung hòa tương đương nhau tại thời điểm D42.
 |
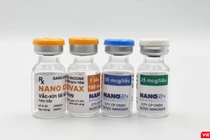
| Vaccine phòng COVID-19 Nano Covax (Ảnh - Nanogen) |
Sau khi nghiên cứu thử nghiệm lâm sàng giai đoạn 2 hoàn tất, Nanogen đánh giá vaccine phòng COVID-19 Nano Covax có đáp ứng miễn dịch thể hiện qua nồng độ anti-S-IgG và hoạt tính trung hoà cao hơn rất nhiều lần nhóm giả dược. Tham khảo dữ liệu đáp ứng miễn dịch vaccine cùng và khác bản chất, có xu hướng tương tự.
Qua kết quả giai đoạn 1 và 2 cho thấy, cả 3 liều vaccine phòng COVID-19 Nano Covax 25mcg, 50mcg và 75mcg đều có định lượng Anti-S IgG và hiệu giá kháng thể trung hoà tăng cao vào ngày 35, sau tiêm mũi 1. Sự khác biệt giữa 3 liều này không có ý nghĩa thống kê. Vì vậy, Nanogen đề xuất chọn liều Nanocovax 25mcg để tiếp tục nghiên cứu giai đoạn 3.
Theo báo cáo của Nanogen với Bộ Y tế, đến nay, vaccine phòng COVID-19 Nano Covax đã tiêm thử nghiệm lâm sàng trên 13.620 tình nguyện viên. Trong đó, 60 người thuộc giai đoạn 1, 560 người thuộc giai đoạn 2 và 13.000 người giai đoạn 3. Trong giai đoạn 3 đã có 1.004 người tiêm đủ 2 liều.
Công ty sẽ tiếp tục bổ sung, hoàn thiện hồ sơ sản phẩm, nghiên cứu thử nghiệm tiền lâm sàng và lâm sàng để báo cáo Bộ Y tế vào tuần sau.
Ông Nguyễn Ngô Quang - Phó Cục trưởng Khoa học công nghệ và Đào tạo, Bộ Y tế cho biết - vaccine phòng COVID-19 Nano Covax do Công ty Nanogen nghiên cứu và sản xuất là vaccine COVID-19 đầu tiên do Việt Nam sản xuất thử nghiệm trên người.
Vaccine bắt đầu được thử nghiệm trên người từ tháng 12/2020. Thử nghiệm lâm sàng bao gồm 3 giai đoạn, dự kiến giai đoạn một sẽ thử nghiệm trên 20 người, giai đoạn hai thử nghiệm trên 600 người và giai đoạn ba hơn 10.000 người. Hệ thống nhà xưởng sẵn có của NANOGEN có thể sản xuất ngay 50.000 - 100.000 liều/mẻ (20-30 triệu liều/năm) và tăng dần lên tới 100 triệu liều/năm để đáp ứng nhu cầu trong nước và xuất khẩu.