|
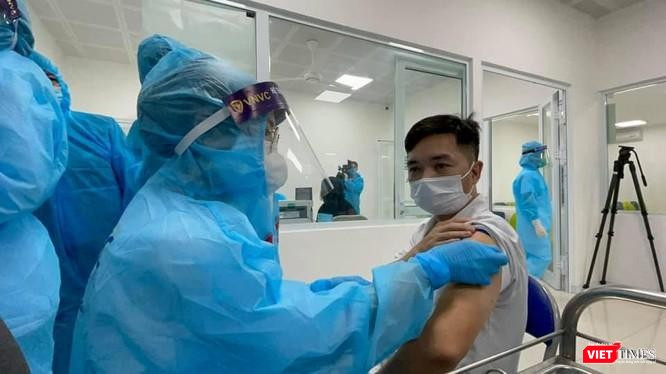
| Thứ trưởng Bộ Y tế cho biết, 3 ứng cử viên vaccine nghiên cứu trong nước, gồm Nanocovax, Covivax, Arct 154 đang thử nghiệm lâm sàng và tiếp tục được hoàn thiện hồ sơ. |
Thông tin được công bố tại cuộc họp báo Chính phủ thường kỳ tháng 3 diễn ra chiều 4/4.
Theo Thứ trưởng Đỗ Xuân Tuyên, Nanocovax là 1 trong 3 ứng cử viên vaccine nghiên cứu trong nước, cùng với Covivax, Arct 154. 3 ứng cử viên này đang trong quá trình thử nghiệm lâm sàng và tiếp tục được hoàn thiện hồ sơ.
Theo Thứ trưởng Tuyên, ngay từ đầu dịch bùng phát, Bộ Y tế đã chỉ đạo, khuyến nghị các đơn vị, cơ quan nghiên cứu khoa học tham gia sản xuất vaccine trong nước. Đến giờ, Việt Nam có 3 ứng cử viên vaccine là: Nanocovax, Covivax, Arct 154.
Thứ nhất là vaccine Nanocovax - sản phẩm của Công ty cổ phần công nghệ sinh học Nanogen, đến bây giờ Nanogen đã nghiên cứu thử nghiệm lâm sàng giai đoạn 3, đánh giá giữa kỳ giai đoạn 3. Vaccine này đã được Hội đồng Đạo đức cũng như Hội đồng Tư vấn cấp phép của Bộ Y tế họp đánh giá.
Ông Tuyên cho biết, qua rà soát hồ sơ của ứng cử viên này, vẫn còn một số dữ liệu mà Hội đồng đề nghị Nanogen bổ sung. Hiện nay, công ty Nanogen đang tổng hợp bổ sung dữ liệu cho Hội đồng Tư vấn cấp phép. Sau khi bổ sung tiếp được tài liệu đó, Hội đồng tiếp tục họp, nếu đủ điều kiện, Hội đồng sẽ trình Bộ Y tế cấp phép vaccine này.
Đối với vaccine Covivax do Viện Vaccine và sinh phẩm y tế nghiên cứu, cũng đã được đánh giá giữa kỳ của thử nghiệm lâm sàng giai đoạn 1 và đang đánh giá giai đoạn 2, hoàn thiện đề cương hồ sơ để thử nghiệm giai đoạn 3.
ARCT 154 là vaccine sản suất công nghệ RNA do công ty cổ phần công nghệ sinh học Vinbiocare nhận chuyển nhượng công nghệ từ công ty Arcturus Therapeutics Hoa Kỳ. Vaccine này đã đánh giá giữa kỳ giai đoạn 1, giai đoạn 2, đang triển khai giai đoạn 3a, 3b, và đã đánh giá giữa kỳ thử nghiệm lâm sàng trên 1.000 người tình nguyện đầu tiên.
Cả 3 ứng cử viên này đang thử nghiệm lâm sàng, và tiếp tục hoàn thiện hồ sơ. Khi các đơn vị hoàn thiện hồ sơ theo yêu cầu của Hội đồng Đạo đức và Hội đồng Tư vấn cấp phép, trên cơ sở đánh giá của hai hội đồng này, nếu đủ điều kiện thì Bộ Y tế sẽ tiến hành cấp phép cho các loại vaccine này.
"Vaccine là sinh phẩm tiêm cho con người nên yêu cầu đánh giá mức độ an toàn rất cao, tránh tai biến tức thì khi tiêm vaccine chưa được nghiên cứu và đánh giá đầy đủ" - Thứ trưởng Đỗ Xuân Tuyên nói thêm.