LTS: Sau ý kiến của TS. Bùi Lê Minh, Đại học Nguyễn Tất Thành, Tp.HCM; chuyên gia miễn dịch Wynn Trần, Tổ chức Y khoa VietMD, Hoa Kỳ; VietTimes tiếp tục đề tài sản xuất vắc xin Covid-19 trong nước với ý kiến của PGS.TS. Trần Văn Hiếu, chuyên gia virus và miễn dịch của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Tp.HCM.
 |
Pv Hải Văn: Khi bàn một vắc xin nào đó có đạt yêu cầu để cấp phép lưu hành hay không thì cần phải dùng đến những thuật ngữ nhất định; và để người viết, người nói với người đọc, người nghe không hiểu nhầm nhau thì cần phải có sự thống nhất về thuật ngữ. Là một người du học nhiều năm nước ngoài lại am tường chuyên môn miễn dịch, xin ông cho biết những cách đối dịch Việt Anh như sau đã đủ minh xác và đã được giới chuyên môn thống nhất sử dụng rộng rãi chưa: Tính an toàn (safety), tính sinh miễn dịch (immunogenicity), hiệu quả trong thử nghiệm lâm sàng (efficacy), và hiệu quả trong thực tế (effectiveness)?
PGS.TS. Trần Văn Hiếu: Các thuật ngữ tính an toàn (safety), tính sinh miễn dịch (immunogenicity), hiệu quả trong thử nghiệm lâm sàng (efficacy), và hiệu quả trong thực tế (effectiveness) đều được dịch chính xác về thuật ngữ chuyên môn cũng như chuyển tải đúng ý nghĩa trong thực tế.
PV: Tính an toàn (safety) đo bằng gì, có ý kiến nói nếu tiêm nước cất vào người thì an toàn gần như tuyệt đối, nói vậy có đúng không thưa ông? Khi Hội đồng Đạo đức kết luận một ứng viên vắc xin đạt tính an toàn thì điều đó có nghĩa là gì và họ dựa vào những căn cứ nào?
 |
PGS.TS. Trần Văn Hiếu: Tôi hay nói vui không có gì là an toàn cả nếu như không đề cập đến liều lượng, kể cả nước cất. Nước cất muốn tiêm vào cơ thể phải sử dụng loại chuyên để tiêm với một liều lượng cụ thể. Do nước cất không có muối nên khi đưa vào trong cơ thể quá liều có thể dẫn tới mẩn ngứa, khó thở, sưng mặt, môi, lưỡi hoặc cổ họng, sốt, đỏ, và sưng hoặc đau ở chỗ tiêm.
Khi Hội đồng Đạo đức kết luận một ứng viên vắc xin đạt tính an toàn thì họ dựa trên việc có phản ứng phụ (như sốt, nhức đầu, mỏi mệt,…) hoặc phản ứng phụ có quá nghiêm trọng sau tiêm hay không. Kết quả đó luôn đi kèm với một liều lượng nhất định và liệu trình nhất định.
 |
PV: Về nguyên liệu làm vắc xin, thì được biết Nanocovax có dùng tá dược (adjuvants) chứa muối nhôm. Có ý kiến băn khoăn rằng mặc dù nhôm đã được dùng trong tá dược vắc xin phổ biến từ gần thế kỷ nay nhưng đó là đối với những loại vắc xin khác, chứ vắc xin ngừa virus gây viêm phổi cấp mà dùng tá dược gốc nhôm thì rất có hại, bởi nhôm có thể làm trầm trọng thêm bệnh lý tăng bạch cầu ưa axit ở phổi (lung eosinophilic pathology) một khi người đã tiêm vắc xin bị phát chứng bệnh này. Xin ông có ý kiến về nhận định này?
PGS.TS. Trần Văn Hiếu: Đúng là tá dược muối nhôm aluminum phosphate hay phèn nhôm aluminum hydroxide đã được chứng minh là an toàn và sử dụng trong nhiều loại vắc xin từ trước đến nay như vắc xin cho bạch hầu, ho gà, uốn ván, viêm màng não, viêm gan siêu vi A/B, ung thư cổ tử cung, phế cầu khuẩn, v.v.
Việc sử dụng tá dược nhôm trong vắc xin cho bệnh viêm phổi cấp không mới. Trước đây đã được sử dụng cho vắc xin phòng SARS-CoV, MERS-CoV, hay thậm chí cho SARS-CoV-2 (vắc xin Vero Cell).
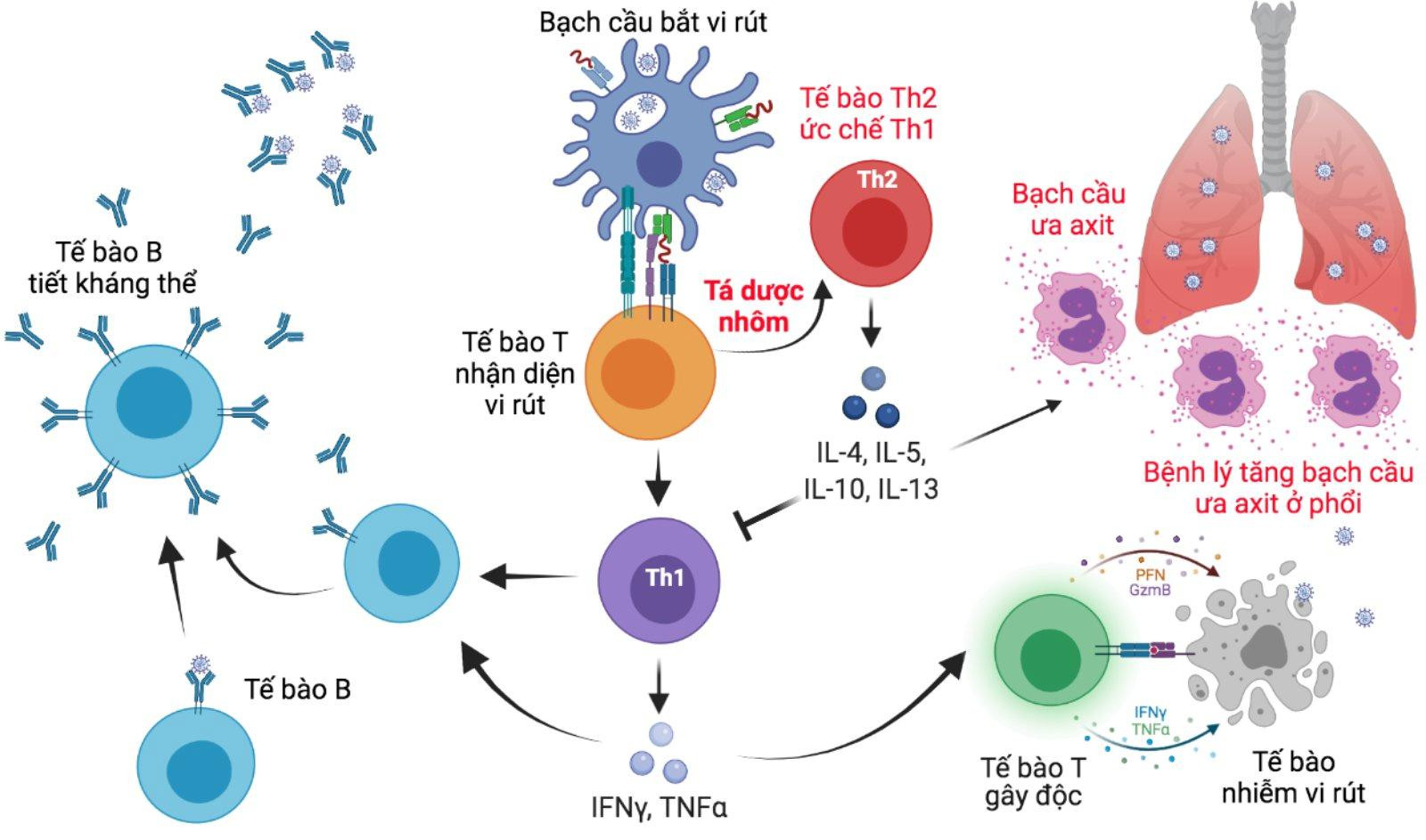
Các nghiên cứu trên mô hình động vật cho thấy sau khi tiêm vắc xin (SARS-CoV, MERS-CoV) và cho tiếp xúc với vi rút sống tương ứng (SARS-CoV, MERS-CoV) thì động vật có hiện tượng tổn thương phổi do có sự xâm nhập của bạch cầu ưa axit (bạch cầu ái toan) vào phổi. Hiện tượng này không xảy ra khi cho tiếp xúc với các vi rút gây viêm phổi khác như vi rút cúm mùa.
Một trong những giải thích là do tá dược nhôm khiến cho cơ thể thiên về xu hướng tạo đáp ứng tế bào theo Th2 (T helper 2: tế bào T trợ giúp, loại 2) hơn, thay vì theo Th1 (T helper 1: tế bào T trợ giúp, loại 1). Việc tạo đáp ứng với tác nhân gây bệnh thì ngoài tế bào bạch cầu loại B (lympho B) tạo kháng thể thì còn cần thêm tế bào bạch cầu loại T (lympho T). Đối với lympho T thì tuỳ loại tác nhân gây bệnh mà nó sinh ra đáp ứng theo Th1 cho vi rút, vi khuẩn, vi nấm, v.v.; hay Th2 cho dị ứng, ký sinh trùng.
Như vậy, rõ ràng là tá dược nhôm làm đảo lộn đáp ứng cần thiết với vi rút: cần đáp ứng Th1 thì lại cho ra đáp ứng Th2.
 |
Có lẽ rút kinh nghiệm này, mà vắc xin Vero Cell cho SARS-CoV-2 đã phải kiểm tra mức độ tổn thương phổi của động vật sau khi cho tiếp xúc với vi rút sống. Điều khá ngạc nhiên là hiện tượng này, theo công bố, không xảy ra, tức là phổi của động vật thử nghiệm hoàn toàn tương tự như động vật khoẻ mạnh.
PV: Vậy thực tế các vắc xin cùng công nghệ tái tổ hợp protein tiểu đơn vị với Nanocovax như Medigen của Đài Loan, Novavax của Mỹ có dùng tá dược gốc nhôm không, nếu có thì họ phải thêm gì bớt gì để ngăn ngừa tác dụng làm trầm trọng bệnh lý tăng bạch cầu ái toan ở phổi của loại tá dược này?
PGS.TS. Trần Văn Hiếu: Tương tự như vắc xin tiểu đơn vị Nanocovax, vắc xin Medigen của Đài Loan cũng dùng tá dược gốc nhôm còn Novavax của Mỹ thì không dùng. Tuy nhiên, cả hai vắc xin này đều bổ sung hay sử dụng các tá dược khác nhằm định hướng đáp ứng của cơ thể sang Th1. Cụ thể, vắc xin của Medigen của Đài Loan bổ sung thêm tá dược CpG1080, còn Novavax của Mỹ sử dụng tá dược Matrix-M thay cho tá dược nhôm. Cả hai tá dược này đều đã chứng minh là tạo đáp ứng theo Th1 mạnh hơn Th2 dù cho có sử dụng kèm với tá dược nhôm hay không.
Kết quả thí nghiệm trên động vật cho thấy, Medigen không tạo tổn thương phổi khi cho tiếp xúc với vi rút sống nếu vắc xin có bổ sung thêm CpG1080. Ngược lại, khi vắc xin không bổ sung thêm CpG1080 tức chỉ sử dụng tá dược nhôm thì có sự tổn thương mô phổi khá nặng. Có thể vì bằng chứng này mà Medigen đã được cấp phép sử dụng khẩn cấp ở Đài Loan mặc dù mới chỉ có kết quả ở pha 2.
 |
PV: Tính sinh miễn dịch (immunogenicity) được đo lường bằng chỉ số gì, đơn vị đo là gì, và đạt đến con số nào thì coi như đạt yêu cầu, thưa ông?
PGS.TS. Trần Văn Hiếu: Tính sinh miễn dịch (immunogenicity) được hiểu là khả năng kích hoạt đáp ứng miễn dịch của cơ thể với tác nhân đưa vào cơ thể. Đây là một thuật ngữ có nghĩa rộng, tức miễn có bất kỳ giá trị nào cho thấy cơ thể có tạo ra được đáp ứng miễn dịch thì đều có thể coi là có tính sinh miễn dịch được hết. Như tôi đã trao đổi ở trên, việc tạo đáp ứng với tác nhân gây bệnh ngoài tế bào B tạo kháng thể thì còn cần thêm tế bào T, vậy nên kết quả đo lường đáp ứng tế bào B hay đáp ứng tế bào T đều có thể đánh giá được tính sinh miễn dịch cả, có nghĩa đơn vị đo tuỳ thuộc vào việc mình đo đáp ứng nào. Ví dụ như, nếu đánh giá đáp ứng của tế bào B thì sẽ đo lượng kháng thể đặc hiệu với tác nhân gây bệnh, còn đánh giá đáp ứng tế bào T thì thông qua các protein đặc trưng do tế bào T tiết ra.
Ngưỡng đáp ứng bao nhiêu thì đạt yêu cầu thì hơi khó trả lời vì không có một con số chung cho tất cả mà phải đến từ thực nghiệm. Cụ thể, đối với bệnh uốn ván, ngưỡng bảo vệ của vắc xin dựa trên kháng thể trung hoà là 0.01 đơn vị quốc tế (IU)/mL, còn đối với bệnh sởi là 0.02 IU/mL máu. Riêng với SARS-CoV-2 thì hiện nay chưa có con số cụ thể.
PV: Có ý kiến chuyên môn cho rằng vắc xin giúp cơ thể tạo ra được kháng thể đặc hiệu với SARS-CoV-2 cũng không đồng nghĩa với bảo vệ được người tiêm khỏi Covid-19 (có hiệu quả lâm sàng). Xin ông giải thích thêm về nhận định này?
PGS.TS. Trần Văn Hiếu: Như đã trao đổi ở trên, việc tạo đáp ứng với tác nhân gây bệnh, nhất là với vi rút, thì ngoài tế bào B tạo kháng thể thì còn cần thêm tế bào T, đặc biệt là 'tế bào T trợ giúp loại 1 – Th1', và 'tế bào T gây độc' (cytotoxic T cells). Tại sao vậy? Vì vi rút có khả năng trốn vào trong tế bào của cơ thể, nơi mà kháng thể không thể 'nhìn thấy' hay tiếp cận được. Tế bào của cơ thể đã nhiễm vi rút cũng là tế bào không thể cứu vãn và cần loại bỏ sớm để tránh lây lan. Việc loại bỏ này thì kháng thể không làm được dù nồng độ có lớn đến đâu, mà chỉ có tế bào T gây độc (giết tế bào nhiễm) là thực hiện được. Ngoài ra, 'tế bào T trợ giúp 1' (Th1) sẽ giúp 'tế bào T gây độc' hoạt động hiệu quả hơn.
Vậy nên, những vắc xin cho vi rút bao giờ cũng cần đánh giá đáp ứng của tế bào T, đặc biệt là 'tế bào T trợ giúp 1, gọi tắt Th1' và 'tế bào T gây độc' nhằm đảm bảo hiệu quả lâm sàng.
PV: Nếu vậy cần khẳng định, hiệu quả bảo vệ của một vắc xin thì chỉ một phần là nhờ thứ kháng thể đặc hiệu kia, còn lại là do đóng góp của những tác nhân quan trọng khác nữa?
PGS.TS. Trần Văn Hiếu: Ý này tôi đã trả lời ở câu trên rồi. Tóm lại là bên cạnh kháng thể thì phải có đáp ứng tế bào T, đặc biệt là 'tế bào Th1' và 'tế bào T gây độc' thì mới đảm bảo hiệu quả lâm sàng với vi rút.
 |
PV: Hiệu quả lâm sàng (efficacy) và hiệu quả thực tế (effectiveness) khác nhau thế nào, xin ông giải thích giúp?
PGS.TS. Trần Văn Hiếu: Hiệu quả lâm sàng (efficacy) đo lường số ca mắc của nhóm tiêm vắc xin và nhóm tiêm giả dược (placebo) trên những người tình nguyện có kiểm soát thông tin sức khoẻ đầu vào khác nhau thế nào, và được thể hiện bằng tỷ lệ %. Cụ thể, nếu nói hiệu quả lâm sàng của một vắc xin là 80% tức người đã tiêm đủ liều khuyến dùng sẽ giảm 80% nguy cơ mắc SARS-CoV-2, phát triển thành bệnh Covid-19. Còn hiệu quả thực tế (effectiveness) thì đo lường hiệu quả của vắc xin trên một quần thể rộng và không có kiểm soát chặt đầu vào, nên nó chịu ảnh hưởng của nhiều yếu tố như lứa tuổi, tình trạng sức khoẻ, sắc tộc, v.v.
Vậy nên các nhà hoạch định chính sách sẽ quan tâm tới hiệu quả thực tế nhiều hơn là hiệu quả lâm sàng.
 |
PV: Khi một ứng viên vắc xin ngừa Covid-19 chưa có dữ liệu thực tế về hiệu quả bảo vệ thì vẫn có thể cấp phép khẩn cấp, đồng thời yêu cầu sau cấp phép vắc xin dùng bao nhiêu, ở đâu, bao giờ, cho ai phải được cơ quan quản lý nhà nước có thẩm quyền chấp thuận đồng thời người tiêm vẫn phải được theo dõi y như đang thử nghiệm lâm sàng. Theo ông có nên vậy không? Thực tế ở Mỹ và ở những nước khác có làm vậy không?
PGS.TS. Trần Văn Hiếu: Tính tới thời điểm hiện nay, chỉ có vắc xin Medigen là được cấp phép sử dụng khẩn cấp ở Đài Loan mặc dù mới có kết quả ở pha 2. Như đã trao đổi ở trên, họ cấp phép sử dụng khẩn cấp ngoài các lý do chính trị thì kết quả lâm sàng quan trọng nhất mà họ chứng minh được là người tiêm vắc xin có đáp ứng tế bào T và không tạo tổn thương phổi khi cho tiếp xúc với vi rút sống. Hiển nhiên, họ vẫn phải theo dõi người tiêm y như đang thử nghiệm lâm sàng. Hiện họ đã được cấp phép thử nghiệm pha 3 trên người với Cơ quan Quản lý Dược phẩm châu Âu. Nếu Việt Nam hay nước nào khác có thẩm định cấp phép dựa theo trường hợp này thì cần có minh chứng vắc xin có đáp ứng tế bào T và không tạo tổn thương phổi khi cho tiếp xúc với vi rút sống. Đó là thứ điều kiện cần, không có không xong, cho việc cấp phép khẩn cấp có điều kiện.
 |
PV: Cấp phép khẩn cấp chỉ dùng trong những tình huống khẩn cấp. Vậy xin ông cho biết thế nào là tình huống khẩn cấp? Và khi tình hình biến chuyển thế nào thì một tình huống khẩn cấp sẽ không còn là khẩn cấp nữa?
PGS.TS. Trần Văn Hiếu: Để quyết định một sản phẩm bao gồm vaccine, sinh dược phẩm, và thiết bị chẩn đoán có được phép sử dụng khẩn cấp hay không thì Tổ chức Y tế thế giới (WHO) căn cứ trên bốn tiêu chí:
- Sản phẩm được sử dụng cho bệnh nghiêm trọng hay bệnh có ảnh hưởng tức thì tới sự sống, có khả năng bùng phát thành dịch hay đại dịch mà chưa có sản phẩm được cấp phép nào có thể giúp chữa, chặn;
- Sản phẩm hiện có không hiệu quả trong việc loại bỏ hay ngăn ngừa bệnh bùng phát;
- Sản phẩm được sản xuất theo tiêu chuẩn hướng dẫn hiện hành của Thực hành sản xuất tốt (GMP: Good Manufacture Practice) cho vaccine và sinh dược phẩm, hay Quản lý chất lượng tốt (QMS: Quality Management System) cho thiết bị chẩn đoán;
- Nhà sản xuất đủ khả năng đáp ứng quá trình phát triển sản phẩm (bao gồm cả thử nghiệm lâm sàng) và cung cấp hồ sơ tiền đánh giá cho WHO.
Như vậy một sản phẩm sẽ không cần cấp phép sử dụng khẩn cấp nữa khi một trong bốn tiêu chí trên không thoả mãn, ví dụ như đã có sản phẩm hiện hành có hiệu quả trong việc loại bỏ hay ngăn ngừa bệnh bùng phát.
 |
PV: Ngoài Nanocovax, đề nghị ông bình luận thêm về tính an toàn, tính sinh miễn dịch, hiệu quả lâm sàng, và hiệu quả thực tế của những loại vắc xin khác đang được nghiên cứu, sản xuất ở Việt Nam?
PGS.TS. Trần Văn Hiếu: Ngoài Nanocovax đang được nghiên cứu, sản xuất, hiện nay Việt Nam có thêm ứng viên vắc xin Covivac của Viện Vắc xin và Sinh phẩm Y tế (IVAC) đang thử nghiệm pha 2, ứng viên vắc xin mRNA tự sao chép ARCT-154 của VinBioCare đang thử nghiệm pha 2 và 3a. Hai ứng viên vắc xin này đều cho thấy tính an toàn, tính sinh miễn dịch tốt, và chưa có công bố về hiệu quả lâm sàng, và hiệu quả thực tế.
Xin nói thêm rằng Covivac sử dụng công nghệ tương tự vắc xin AstraZeneca (sử dụng virus không gây bệnh ở người để đưa tác nhân gây bệnh) còn ARCT-154 sử dụng công nghệ tương tự vắc xin Moderna hay Pfizer nhưng có cải tiến.
Trân trọng cảm ơn và kính chúc ông sức khoẻ!
Đón đọc: Sản xuất Vắc xin trong nước – Phân biệt 'Gia công đóng gói bán thành phẩm' với 'Chuyển giao công nghệ'