 |
| Là DN thuần Việt nhưng Pharbaco sẽ trở thành tay chơi đáng gờm bậc nhất trên thị trường dược Việt Nam sau khi siêu nhà máy mới xây dựng được công nhận đạt tiêu chuẩn EU – GMP. |
Theo nhận định của CTCP Chứng khoán SSI (SSI), nhu cầu nguyên liệu sản xuất dược phẩm ở Việt Nam phụ thuộc tới 80 – 90% vào nguồn nhập khẩu. Đây luôn là vấn đề của Việt Nam trong dài hạn. Bởi vì, để sản xuất được dược liệu đòi hỏi phải đầu tư nhiều và cần có khả năng về công nghệ (Việt Nam không có lợi thế cạnh tranh so với các nước khác, như Trung Quốc và Ấn Độ).
Trong bối cảnh dịch bệnh Covid-19 còn diễn biến phức tạp, doanh nghiệp dược phẩm sẽ chịu nhiều tác động tiêu cực về nguồn cung nguyên liệu. Tác động ít hay nhiều sẽ phụ thuộc vào chính sách tĩch trữ nguyên liệu của từng doanh nghiệp.
Nhưng dịch bệnh Covid-19 đang làm ảnh hưởng không nhỏ đến tiến độ phát triển các nhà máy sản xuất dược phẩm tiêu chuẩn EU – GMP của các doanh nghiệp dược trong nước. Nguyên nhân là do việc di chuyển của các chuyên gia và đối tác giữa các quốc gia bị hạn chế bởi dịch bệnh, cản trở tiến độ xây dựng, và thẩm định tiêu chuẩn.
Theo thống kê của SSI, tính đến ngày 30/11/2019, số lượng dây chuyền sản xuất hay nhà máy đạt tiêu chuẩn chất lượng sản xuất EU – GPM/Nhật Bản - GMP hoặc PIC/s đạt 19 trong số 203 nhà máy dược phẩm, thuộc hơn 170 công ty sản xuất dược trong nước và các công ty đa quốc gia.
Việc các sản phẩm đạt tiêu chuẩn chất lượng cao được SSI đánh giá sẽ là lợi thế cạnh tranh cho các công ty dược phẩm trong nước.
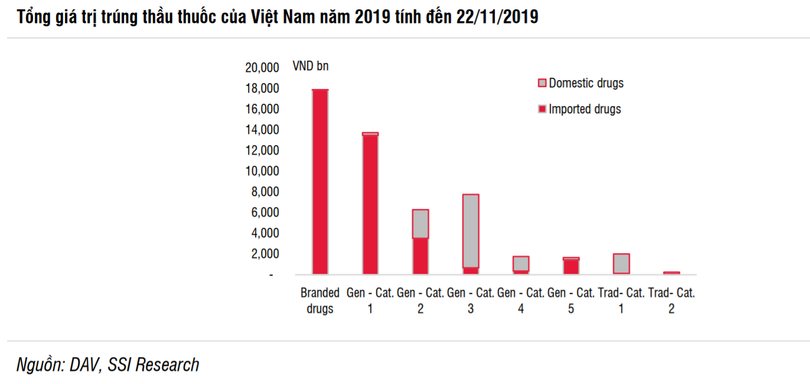 |
| Thuốc nhóm 1 và 2 vẫn đang là "sân chơi" riêng của doanh nghiệp ngoại |
Ngày 1/10/2019, Thông tư 15/2019/TT-BYT của Bộ Y tế quy định việc đấu thầu thuốc tại các cơ sở y tế công lập chính thức có hiệu lực. Đây là thông tư sửa đổi của Thông tư 11/2016/TT-BYT mà Bộ Y tế đã ban hành trước đó.
Cụ thể, Thông tư quy định rõ trong Nhóm 5 và Nhóm 2, các loại thuốc nhập khẩu có thể không được phép chào thầu nếu thuốc sản xuất trong nước đáp ứng tiêu chuẩn WHO-GMP và EU-GMP tương ứng về cùng một hoạt chất chính (API), và nếu năng lực sản xuất của công ty có thể đáp ứng đầy đủ nhu cầu.
Bên cạnh đó, các bệnh viện và phòng khám công lập ở Việt Nam sẽ không chào thầu thuốc nhập khẩu mà thuốc này được chi trả bằng ngân sách nhà nước hoặc quỹ bảo hiểm y tế. Cơ sở y tế sẽ không được mời thầu thuốc nhập khẩu nếu có ít nhất 3 công ty dược phẩm trong nước có thể cung ứng các loại thuốc này về điều trị, đồng thời đáp ứng các tiêu chuẩn về giá và khả năng cung cấp.
SSI đánh giá, quy định đấu thầu công khai đối với thuốc là một lợi thế đối với các công ty sản xuất thuốc ở Việt Nam đạt tiêu chuẩn cao về chất lượng sản xuất. Đồng thời, chính sách này cũng nhằm khuyến khích gia công thuốc nước ngoài, cũng như chuyển giao công nghệ của thuốc nước ngoài, để sản xuất tại Việt Nam.
 |
| 5 nhóm thuốc generics trong đấu thầu thuốc tại cơ sở y tế công lập |
Trong số các công ty niêm yết, CTCP Dược phẩm Imexpharm (Mã CK: IMP) và CTCP Pymepharco (Mã CK: PME) là những công ty đã đạt chứng nhận EU – GMP cho 2 dây chuyền sản xuất, trong khi CTCP Dược Hậu Giang (Mã CK: DHG) có chứng nhận cho cả 2 tiêu chuẩn PIC/s và Nhật Bản-GMP.
Bên cạnh đó, như VietTimes từng đề cập, CTCP Dược phẩm trung ương I (Pharbaco – Mã CK: PBC) cũng đang đang tiến hành xây dựng dự án nhà máy bào chế dược phẩm đạt tiêu chuẩn EU – GMP.
Pharbaco là một trong số ít các doanh nghiệp nội tự triển khai dự án nhà máy dược phẩm đạt tiêu chuẩn EU – GMP mà không có sự tham gia của cổ đông nước ngoài như nhiều doanh nghiệp khác.
Hiện nay, Pharbaco đã thực hiện giai đoạn 1 của dự án với tổng vốn đầu tư 1.200 tỷ đồng. Do ảnh hưởng của dịch Covid-19, các chuyên gia gần như không thể sang Việt Nam để phối hợp vận hành máy móc, tuy nhiên, Pharbaco vẫn đặt mục tiêu sẽ hoàn thành và thẩm định xong nhà máy EU – GMP vào Quý 3/2020.
 |
| Tổng quan dự án Nhà máy Pharbaco EU - GM (Nguồn: AT Bách Khoa) |
Về giai đoạn 2 của dự án, Pharbaco đang nhanh chóng lên kế hoạch triển khai, tổng mức đầu tư dự kiến khoảng 800 tỷ đồng. Nguồn vốn thực hiện dự kiến sẽ được huy động từ cổ đông chiến lược và vay ngân hàng.
Việc sở hữu nhà máy đạt chuẩn EU – GMP sẽ giúp dược phẩm của Pharbaco đủ tiêu chuẩn đấu thầu ở nhóm 1 và 2 trên kênh ETC (bệnh viện, phòng mạch) và tiến gần hơn đến mục tiêu trở thành 1 trong 10 doanh nghiệp dược phẩm có sản lượng lớn nhất Việt Nam.
Theo báo cáo của Mirae Asset, đơn vị này ước tính tổng giá trị ngành dược của Việt Nam năm 2019 đạt khoảng 6,95 tỷ USD, tăng 11% so với năm 2018. Trong đó, thuốc nhập khẩu vẫn chiếm lĩnh thị trường dược phẩm, do đó việc sở hữu nhà máy chuẩn EU - GMP giúp chia lại thị phần ngành dược tại Việt Nam.
Năm 2020, Bộ Y tế đặt mục tiêu nâng mức tiêu thụ thuốc nội địa lên 22% tại các bệnh viện trung ương, và lên 50% và 75% tại các bệnh viện và các cơ sở y tế tuyến tỉnh, tuyến huyện./.









































